El ayuno intermitente se ha incorporado de manera creciente en la práctica clínica como intervención para la mejora metabólica. No obstante, la reducción temporal del aporte de fibra fermentable puede inducir cambios significativos en la microbiota intestinal, especialmente en la producción de ácidos grasos de cadena corta y en la integridad de la barrera mucosa. Este artículo examina los mecanismos fisiológicos que explican estas alteraciones, discute las manifestaciones clínicas asociadas y propone estrategias basadas en evidencia para implementar el ayuno de forma que sus beneficios no comprometan la salud intestinal.
El ayuno intermitente (AI) se define por periodos programados de restricción completa o parcial de la ingesta calórica. Se ha demostrado que esta estrategia contribuye a la regulación del metabolismo de la glucosa, la disminución de la inflamación sistémica de bajo grado y la reducción de adiposidad central. Estas propiedades han favorecido su adopción como herramienta terapéutica para la resistencia a la insulina, el síndrome metabólico y diversas patologías cardiometabólicas.
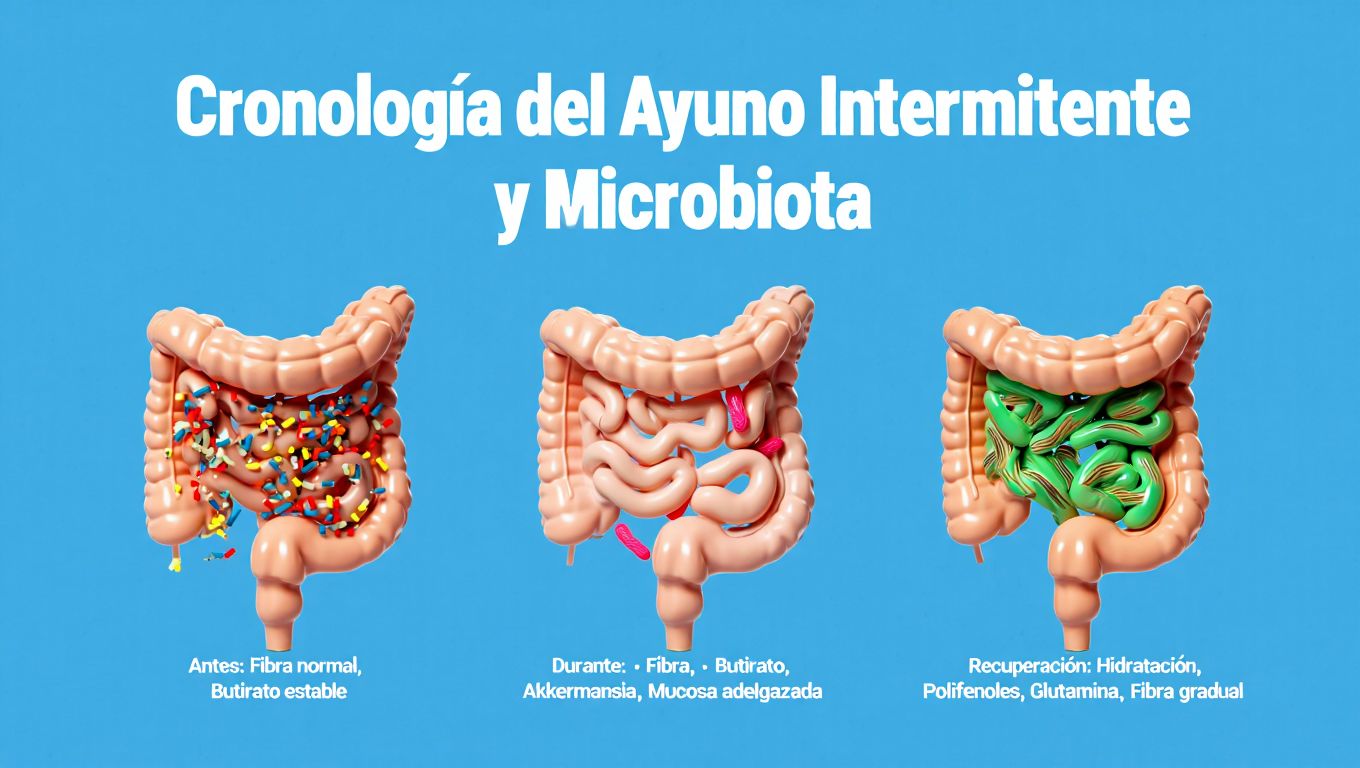
Sin embargo, la microbiota intestinal depende de la disponibilidad continua de carbohidratos no digeribles para la producción de ácidos grasos de cadena corta (AGCC), en particular butirato. El butirato constituye la principal fuente energética para los colonocitos y participa en la regulación inmunológica local y en el mantenimiento de las uniones estrechas que preservan la barrera intestinal (1,3). La reducción sostenida en la fermentación bacteriana, propia de los periodos prolongados sin ingesta alimentaria, puede alterar este equilibrio.
Asimismo, cuando los sustratos fermentables disminuyen, ciertos microorganismos comienzan a utilizar la mucina secretada por las células caliciformes como fuente alternativa de energía. Este fenómeno, inicialmente adaptativo, puede conducir a una reducción progresiva del grosor de la capa mucosa y a una mayor exposición epitelial a lipopolisacáridos bacterianos, promoviendo inflamación local y sistémica (2,4). En consecuencia, la implementación de protocolos de AI requiere considerar no solo su impacto metabólico general, sino también su efecto sobre la ecología intestinal.
Modulaciones microbianas inducidas por el ayuno
La reducción de la disponibilidad de fibra durante el ayuno disminuye la fermentación colónica y reduce las concentraciones de AGCC. Esta disminución afecta procesos regenerativos epiteliales y modula la señalización de células inmunes residentes (1,3). La pérdida sostenida de butirato se ha asociado con alteraciones en la capacidad de reparación mucosa, incremento de la permeabilidad intestinal y mayor susceptibilidad a la inflamación inducida por endotoxinas (4).
Frente a la ausencia de carbohidratos complejos, especies bacterianas mucinolíticas, como Akkermansia muciniphila y ciertas especies de Bacteroides, incrementan el catabolismo de mucina (2).
En estudios controlados, este proceso es inicialmente beneficioso, ya que estimula la renovación del moco y presenta correlación con mejor sensibilidad a la insulina (5,6). Sin embargo, cuando la restricción se prolonga o se repite sin adecuado soporte prebiótico, la erosión mucosa supera la capacidad de renovación y se compromete la integridad de la barrera intestinal.
Los estudios que evalúan cambios composicionales muestran aumentos consistentes de Akkermansia muciniphila tras periodos de ayuno, lo cual se ha relacionado con beneficios metabólicos (5,6). No obstante, también se observa disminución de bacterias productoras de butirato como Faecalibacterium prausnitzii cuando la dieta no garantiza un adecuado aporte de fibra durante las ventanas alimentarias (1,3). Esta relación dinámica subraya la necesidad de considerar el contenido cualitativo de la dieta y no solo su cronología.
Variación según la duración y el patrón del ayuno
Los efectos descritos dependen de la duración del periodo de abstinencia y de la composición de la alimentación posterior. Protocolos de 12 horas presentan un impacto mínimo sobre la fermentación colónica, mientras que ventanas superiores a 18 horas pueden disminuir significativamente los niveles de butirato si la dieta posterior es insuficiente en fibra soluble. Los ayunos de 24 horas o más incrementan considerablemente la probabilidad de degradación mucinolítica sostenida, por lo que su aplicación requiere medidas compensatorias explícitas.
Manifestaciones clínicas de alteración de la barrera mucosa
La disfunción de la barrera intestinal inducida por cambios microbianos puede manifestarse con distensión postprandial, tránsito intestinal enlentecido, mayor sensibilidad visceral e intolerancia alimentaria secundaria (7). En algunos casos, se observan alteraciones en el sueño y el estado emocional, lo cual puede relacionarse con la disminución de AGCC y su efecto sobre el eje intestino-cerebro. Estas manifestaciones deben ser interpretadas como indicadores tempranos de compromiso mucoso y no como adaptaciones fisiológicas deseables.
Estrategias de preservación mucosa durante el ayuno
Diversas intervenciones pueden prevenir la disminución sostenida de AGCC y el adelgazamiento de la capa mucosa, sin interferir con los beneficios metabólicos del AI. La hidratación adecuada, acompañada de electrolitos sin aporte calórico, favorece la motilidad intestinal y modula la actividad neuro entérica. La inclusión de compuestos polifenólicos durante la ventana de ayuno ha mostrado capacidad para modular la microbiota y favorecer especies beneficiosas sin alterar los parámetros glucémicos (8). Asimismo, la suplementación con L-glutamina ha demostrado eficacia en la restauración de la barrera epitelial y en la reducción de la permeabilidad intestinal en pacientes con trastornos funcionales (9).
Un aspecto central es la reintroducción alimentaria. La transición brusca desde el ayuno hacia comidas densas puede incrementar la fermentación rápida y generar sintomatología digestiva. La literatura sugiere que la reintroducción gradual, comenzando con preparaciones líquidas suaves y progresando hacia proteínas, grasas y posteriormente vegetales y alimentos fermentados, permite restaurar la actividad digestiva sin sobrecargar la mucosa intestinal (10).
Conclusiones
El ayuno intermitente ofrece beneficios metabólicos claros; sin embargo, su implementación adecuada requiere la preservación deliberada de la integridad intestinal. La comprensión de los mecanismos microbianos involucrados permite anticipar riesgos y diseñar intervenciones complementarias que mantengan la función de la barrera y la producción de AGCC. La seguridad del AI depende, en última instancia, no solo de la duración de la abstinencia, sino del enfoque nutricional y clínico que lo acompaña.
Referencias
- Schwiertz A, Taras D, Schäfer K, Beijer S, Bos NA, Donus C, Hardt PD. Microbiota and SCFA in lean and overweight healthy subjects. Obesity (Silver Spring). 2010;18(1):190–195. doi:10.1038/oby.2009.167
- Desai MS, Seekatz AM, Koropatkin NM, Kamada N, Hickey CA, Wolter M, Pudlo NA, Kitamoto S, Terrapon N, Muller A, Young VB, Henrissat B, Wilmes P, Martens EC. A dietary fiber-deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility. Cell. 2016;167(5):1339–1353.e21. doi:10.1016/j.cell.2016.10.043
- Koh A, De Vadder F, Kovatcheva-Datchary P, Bäckhed F. From dietary fiber to host physiology: Short-chain fatty acids as key bacterial metabolites. Cell. 2016;165(6):1332–1345. doi:10.1016/j.cell.2016.05.041
- Lobionda S, Sittipo P, Kwon HY, Lee YK. The role of gut microbiota in intestinal inflammation with respect to diet and nutritional status. Microorganisms. 2019;7(8):271. doi:10.3390/microorganisms7080271
- Dao MC, Everard A, Aron-Wisnewsky J, Sokolovska N, Prifti E, Verger EO, Kayser BD, Levenez F, Chilloux J, Hoyles L, Dumas ME, Rizkalla SW, Doré J, Clément K. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: Relationship with gut microbiome richness and ecology. Gut. 2016;65(3):426–436. doi:10.1136/gutjnl-2014-308778
- Ouyang J, Lin J, Isnard S, Fombuena B, Peng X, Marette A, Routy B, Messaoudene M, Chen Y, Routy JP. The bacterium Akkermansia muciniphila: A sentinel for gut permeability and its relevance to HIV-related inflammation. Front Immunol. 2020;11:645. doi:10.3389/fimmu.2020.00645
- Staudacher HM, Whelan K. The low FODMAP diet: Recent advances in understanding its mechanisms and efficacy in IBS. Gastroenterology Clinics of North America. 2017;66(8):1517–1527. doi:10.1136/gutjnl-2017-313750
- Anhê FF, Roy D, Pilon G, Dudonné S, Matamoros S, Varin TV, Garofalo C, Moine Q, Desjardins Y, Levy E, Marette A. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp. in the gut microbiota of mice. Gut. 2015;64(6):872–883. doi:10.1136/gutjnl-2014-307142
- Zhou Q, Verne ML, Fields JZ, Lefante JJ, Basra S, Salameh H, Verne GN. Randomised placebo-controlled trial of dietary glutamine supplements for postinfectious irritable bowel syndrome. Gut. 2019;68(6):996–1002. doi:10.1136/gutjnl-2017-315136
- Valdes AM, Walter J, Segal E, Spector TD. Role of the gut microbiota in nutrition and health. BMJ. 2018;361:k2179. doi:10.1136/bmj.k2179
